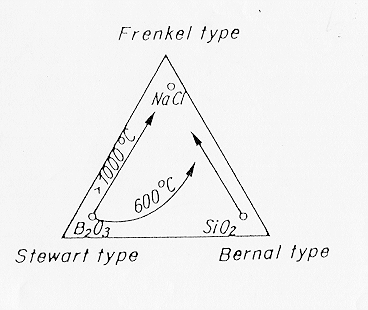
MODELLI DEL FUSO
Weil ha tentato di mettere in relazione i 3 modelli più importanti sulla struttura del fuso: Bernal Frenkel e Stewart.
1.1) Modello di Bernal: Bernal considera un fuso come costituito da sfere rigide che si dispongono casualmente in una scatola. Sperimentalmente si può dimostrare che lo stato disordinato di un fuso è causato da una modesta percentuale di sfere che assumono un numero di coordinazione diverso da quello normale per un impacchettamento di sfere rigide di uguali dimensioni : 5 o 7 invece di 6 : un liquido di Bernal può quindi essere descritto da un numero di coordinazione delle particelle e da una funzione di disordine. Questo fuso non contiene né aree cristalline né cavità capaci di accogliere particelle: esso viene detto "privo di difetti".
A causa della sua considerevole "reticolazione" intesa come interazione tra gli atomi che lo compongono il fuso ha un’alta viscosità che favorisce in raffreddamento la formazione di vetro. (La fusione della cristobalite porta ad un liquido la cui struttura approssima molto bene il modello di Bernal).
1.2) Modello di Frenkel: si suppone, all’opposto del modello precedente, che su scala atomica un certo numero di legami si aprano e contemporaneamente in altre zone del liquido altri legami si chiudano in modo che il fuso possa essere considerato come un sistema dinamico di cavità e di fratture. Questa è la situazione di un fuso molto fluido derivante dalla elevata "fessurazione" della struttura. Difficilmente un tale fuso può dare origine ad un vetro (NaCl).
1.3) Modello di Stewart: nel fuso sono presenti degli "aggregati molecolari" con un certo grado di ordine comunque inferiore a quello di regioni cristalline (regioni cibotattiche) questo modello può spiegare il comportamento di certi liquidi che appaiono birifrangenti .Le regioni cibotattiche possono condurre alla compresenza nel fuso di più fasi che tendono a scomparire all’aumentare della temperatura.
Come si vede in figura 1 § 4.1 Weil ha tentato di classificare i fusi vetrosi in funzione dei tre tipi di liquidi, di regola i fusi che danno origine a vetri sono vicini al modello di Bernal tuttavia i fusi fosfatici hanno mostrato sperimentalmente di contenere strutture a "catena": se si "tira" un vetro fosfatico in fibre le catene si orientano nella direzione delle tensioni causando birifrangenza (stesso comportamento: B2O3 -elementi planari-.).
Figura 1 § 4.1

Le frecce in figura mostrano che un fuso di silice tipo Bernal per aggiunta di alcali tende a trasformarsi in un fuso di tipo Frenkel, anche la temperatura gioca un ruolo importante facendo spostare fusi di tipo Stewart e Bernal verso fusi di tipo Frenkel, effetto opposto lo otteniamo invece sottoponendo il liquido ad una pressione elevata .
1) Immiscibilità liquido-liquido
Già Shott nei primi anni di questo secolo aveva osservato che miscele di ossidi vetro-formatori in certi rapporti stechiometrici davano luogo nel vetro risultante dal raffreddamento del fuso ad una opalescenza più o meno accentuata. Un esempio tipico è quello dei sistemi silico-boratici nei quali si ha compresenza di due ossidi con una piccola differenza di forza di campo secondo Dietzel (D F = 0,03).
Successivamente la presenza di microfasi liquide nei vetri è stata confermata da indagini svolte con la tecnica della microscopia elettronica a scansione (SEM) e a trasmissione (TEM).
Slayter Prebus ed Oberlies dimostrarono che molti sistemi vetrosi non erano omogenei come ci si sarebbe potuto aspettare dalla teoria del Network continuo di Zachariasen e Warren né d’altra parte risultavano ordinati in una struttura interconnessa di cristalliti come li descriveva la teoria di Lebedev.
Con lo sviluppo della tecnica di preparazione del campione si capì che le disomogeneità riscontrate nella microstruttura dei vetri non derivavano da una cattiva omogeneizzazione del fuso né dalla presenza di infusi o ricristallizzati bensì da veri e propri processi strutturali.
Figura 2 § 4.2

Come possiamo vedere in figura 2 § 4.2, in un sistema vetroso a base di BeF2 il fluoruro di berillio rappresenta un modello più "soft" di quello della silice pura: in certe condizioni di raffreddamento del fuso si manifesta una opalescenza (effetto Tyndall) dovuta alla smiscelazione di microfasi di composizione e densità diverse. Nella figura di destra si notano gocce della dimensione di 30-60 nM il taglio della superficie ha asportato una parte delle gocce facendo apparire una convessità, nella fotografia di destra si nota un cristallo di MoO3 che serve per valutare la superficie del vetro esente da difetti.
1.2)Tecnica del "calco"
Il microscopio elettronico a scansione é uno strumento adatto ad indagini microstrutturali in quanto ha un potere risolutivo enormemente superiore a quello dei tradizionali microscopi ottici: infatti se d è il potere risolutivo cioè la minima distanza tra due punti che possono essere risolti:
![]()
dove l = lunghezza d’onda della radiazione incidente (per la luce visibile 3000-7000 Å ) n è l’indice di rifrazione del mezzo in cui è immerso il campione ed w = apertura dello strumento. Dalla relazione è evidente che il potere risolutivo è tanto migliore quanto più piccola è la lunghezza d’onda della radiazione incidente, poiché la lunghezza d’onda associata ad un elettrone è circa 100000 volte più piccola di quella della luce visibile si arriva nel microscopio elettronico ad una risoluzione teorica di 2-3 Å.
La versatilità della tecnica di microscopia elettronica viene messa bene in evidenza dalle figure 3 e 4 § 4.3: il fascio elettronico incidente, accelerato fino ad avere una certa energia (30 kV) dà origine a una serie di emissioni:
Figura 3 § 4.3
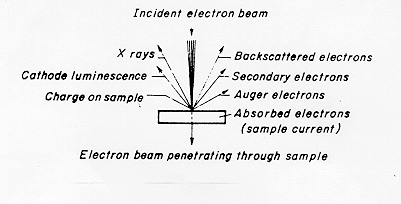
Figura 4
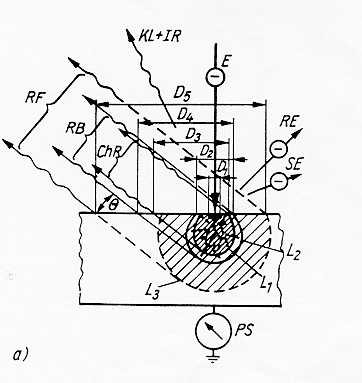
1) elettroni
elettroni backscatterati RE causati da urti elastici degli elettroni del fascio con elettroni degli strati interni degli atomi .I primi vengono riflessi con angoli vicini a 180°
elettroni secondari SE dovuti ad urti anelastici degli elettroni del fascio con elettroni degli strati esterni degli atomi. Si ha diffusione o "scattering" degli elettroni con angoli rispetto alla normale piuttosto elevati
elettroni Auger causati dalla deplezione di elettroni appartenenti agli strati più esterni degli atomi del campione.
2) radiazione elettromagnetica
catodoluminescenza dovuta a riassestamenti elettronici negli strati più esterni degli atomi bersaglio
radiazione X dovuta a transizioni elettroniche negli strati interni degli atomi
si distinguono tre tipi di radiazione X:
radiazione caratteristica ChR è causata dall’interazione degli elettroni accelerati del tubo con
gli elettroni degli strati interni degli atomi bersaglio
radiazione di frenamento Rb è una radiazione policromatica di "bremstrehlung" causata dal
frenamento degli elettroni accelerati del tubo da parte delle nubi elettroniche degli atomi bersaglio.
radiazione di fluorescenza X Rf è causata dall’interazione della radiazione caratteristica ChR
con gli elettroni degli strati interni degli atomi bersaglio
Ciascuna di queste emissioni può essere rivelata con opportuni strumenti (griglie, EDAX..) rendendo estremamente potente questa tecnica di indagine.
La tecnica del calco sviluppata da Bradley e successivamente da Skatulla permette di evitare l’interferenza tra il fascio elettronico ad alto voltaggio ed il supporto; infatti nel caso ad esempio di un vetro a base di silicato di piombo si ha una riduzione dello ione Pb2+ a piombo metallico che provoca una alterazione morfologica nel campione che si sta osservando.
L’ottenimento della superficie vetrosa avviene sotto vuoto mediante un taglio inclinato effettuato a bassa velocità di rotazione della lama del microtomo in modo da non eliminare i dettagli, in questo caso infatti la velocità di frattura è più bassa. (Figura 5) § 4.3 bis
Si effettua una deposizione verticale di carbonio formando sulla superficie un film conduttore e nel contempo resistente all’attacco acido, il campione viene quindi trattato con acidi forti diluiti (una miscela di HF-HCl-HNO3) in modo da provocare il distacco del film di carbonio dal supporto vetroso che viene distrutto. Lo scattering elettronico del carbonio è piuttosto basso e ciò renderebbe l’immagine poco contrastata impedendo di cogliere i dettagli più fini: si esegue allora una deposizione inclinata di un metallo pesante (Au Pt o Ir) per aumentare così il contrasto dell’immagine.
Figura 5 § 4.3 bis
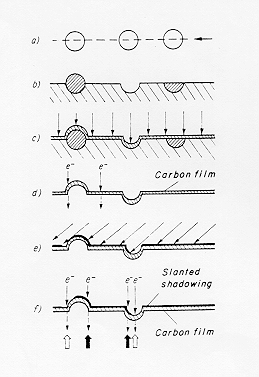
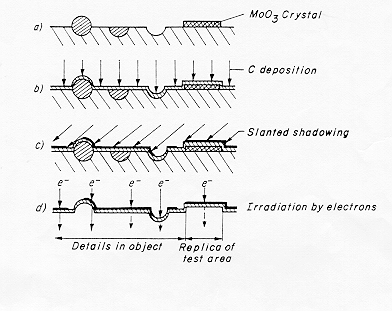
La tecnica è stata ulteriormente sviluppata da Skatulla con la deposizione di un cristallo di MoO3 sulla superficie del campione: dopo aver distaccato la superficie del vetro con il trattamento con acidi diluiti come descritto in precedenza si rimuove il cristallo di ossido di molibdeno (figura 2) § 4.2 con un lavaggio con alcali. Con la deposizione inclinata di metallo pesante (a grana più fine) otteniamo così una superficie di controllo determinata dalla faccia del cristallo: questa superficie serve in pratica a valutare se sulla superficie del vetro i dettagli visibili sono dovuti a strutture reali oppure alla grana del film deposto.
1.3) Sistemi vetrosi che danno immiscibilità
Figura 6 § 4.4
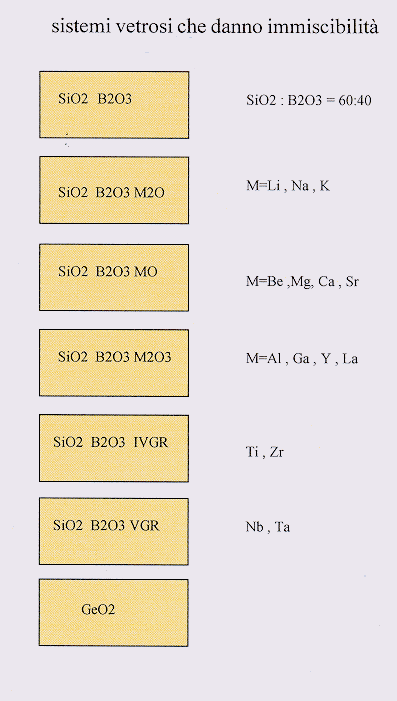
Questi sono generalmente sistemi boro-silicatici ed alcalino -borosilicatici, sistemi ternari con metalli alcalino-terrosi hanno una bassa tendenza alla smiscelazione di fasi per cui essa si osserva solo in qualche regione del diagramma ternario, con gli ossidi dei metalli alcalino-terrosi la tendenza come si è già detto è più pronunciata. I metalli tripositivi (Al+++) presentano immiscibilità in qualche regione e questo ha grande importanza tecnologica visto l’uso di questi sistemi nei vetri per ottica. Recentemente si è visto che anche i vetri allumino-silicatici hanno un comportamento simile: poiché presentano temperature di fusione elevate essi vengono raffreddati con alti gradienti di temperatura e quindi le gocce di immiscibilità nella massa vetrosa risultando molto piccole per lungo tempo sono rimaste invisibili ai mezzi di indagine. I sistemi con ossidi del IV e V gruppo hanno anch’essi una forte tendenza alla immiscibilità così come i germanati.(Figura 6)
Anche aggiunte di fluoruri di idrossidi e solfati al fuso determinano un aumento della tendenza alla smiscelazione: eliminando infatti ossigeni a ponte dal reticolo strutturale si ha un aumento della fluidità del vetro e quindi della mobilità atomica e questo favorisce l’immiscibilità delle fasi vetrose.
1.4) Immiscibilità sub-liquidus
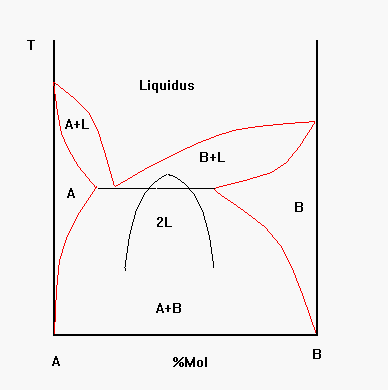
Se osserviamo il diagramma di stato della figura 7 notiamo che molti sistemi presentano una campana di immiscibilità al di sotto della temperatura di liquidus.
Figura 7
1.5) Termodinamica della separazione liquido-liquido
La separazione spontanea di due fasi immiscibili è accompagnata da un abbassamento dell’energia libera del sistema. Alla temperatura T l’energia libera di miscelazione di due fasi liquide sarà:
![]()
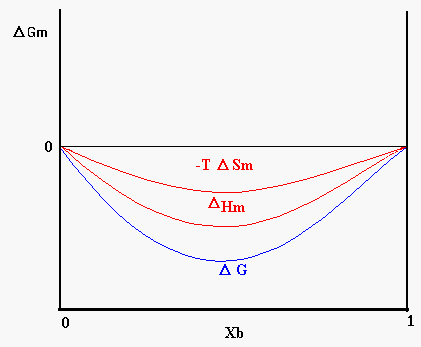
L’entalpia libera e l’entropia sono grandezze funzione della composizione chimica della miscela. Nel caso di due liquidi miscibili in tutte le proporzioni l’andamento dell’energia libera sarà quello mostrato in figura 8, in questo caso D Hm avrà valore negativo o tuttalpiù leggermente positivo.
Figura 8
Nel caso invece che D Hm sia positiva (due liquidi immiscibili) si ha la situazione come in figura 9 § 4.6: raffreddando un liquido di composizione A l’energia libera del sistema si abbassa da una situazione iniziale Ea fino a raggiungere una situazione di equilibrio metastabile con la separazione di due fasi liquide di composizione B e C e con concentrazioni relative Y1 ed Y2 date dalla regola della leva.
Figura 9 § 4.6
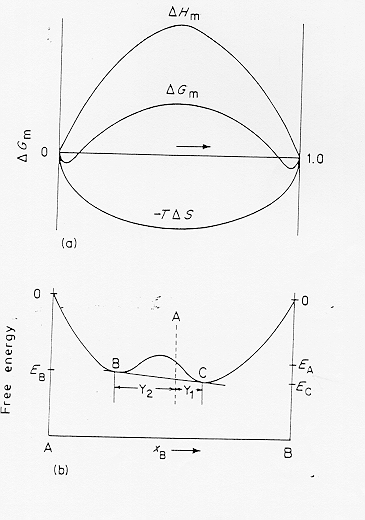
All’aumentare della temperatura nella relazione D Gm =D Hm - T D Sm il termine TD Sm diventa sempre più grande e quindi diminuisce l’altezza della campana . La temperatura critica più alta corrispondente alla scomparsa della campana è detta temperatura del consoluto Tc, figure 10-11 § 4.7.
Figura 10
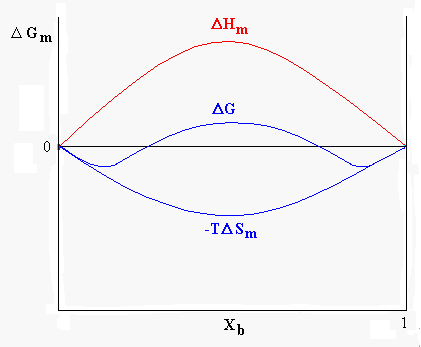
Figura 11 § 4.7
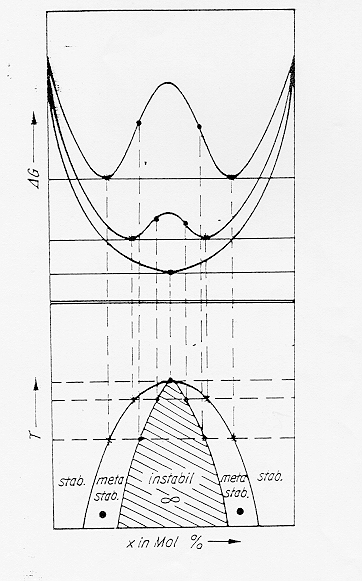
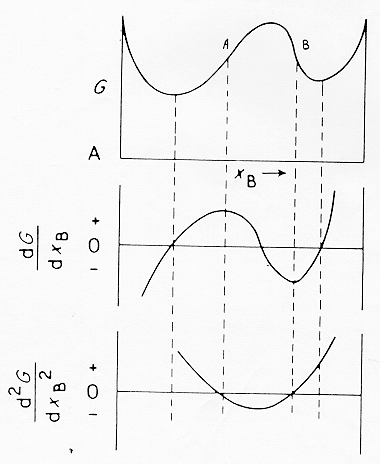
Se osserviamo il diagramma dell’energia libera contro la temperatura in parallelo a quello della temperatura contro la composizione si nota nella parte inferiore la comparsa di una campana di immiscibilità. All’interno della campana esiste un’area (tratteggiata in figura) detta di decomposizione spinodale e limitata dai punti di flesso della curva dell’energia libera.
All’interno di questa zona un fuso si separerà spontaneamente in due liquidi strutturalmente interconnessi a patto di avere sufficiente mobilità atomica. Se la composizione del fuso si trova invece all’esterno della regione spinodale ma all’interno della curva a campana (detta binodale) la separazione in due liquidi non avverrà spontaneamente ma richiederà un processo di nucleazione e successiva crescita che porterà alla formazione di gocce isolate.
Consideriamo ora un liquido omogeneo contenente n atomi e di composizione XB: a causa delle fluttuazioni termiche locali esso potrà deviare dalla composizione media di ![]() , se
, se ![]() è l’energia libera del liquido e G è quella di ciascun atomo allora la probabilità P che un atomo abbia una data energia G sarà secondo Boltzmann:
è l’energia libera del liquido e G è quella di ciascun atomo allora la probabilità P che un atomo abbia una data energia G sarà secondo Boltzmann:
![]() (1)
(1)
Dove D G = G-![]() .La probabilità che n atomi abbiano la stessa energia libera sarà allora:
.La probabilità che n atomi abbiano la stessa energia libera sarà allora:
![]() (2)
(2)
Se D G é piccolo G può essere espanso in una serie di Taylor* secondo xB:
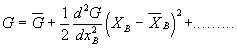 (3)
(3)
se ![]() i termini superiori della serie di Taylor possono essere trascurati e quindi sostituendo l’espressione (3) in (2) si ha:
i termini superiori della serie di Taylor possono essere trascurati e quindi sostituendo l’espressione (3) in (2) si ha:
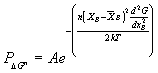 (4)
(4)
P nell’equazione (4) dà la probabilità totale che n atomi del liquido siano coinvolti contemporaneamente in una fluttuazione. Dalla equazione (4) si vede anche che un’alta probabilità di fluttuazione composizionale è associata con un basso valore di ![]() ; in particolar modo P è alta quando la derivata seconda dell’energia libera è negativa; in questo caso la separazione avviene spontaneamente. Dalla figura 12 § 4.8 vediamo che la derivata seconda dell’energia libera diventa negativa all’interno dei due punti di flesso A e B il sistema diviene instabile per infinitesime fluttuazioni di composizione e si avrà quindi separazione di due fasi con un abbassamento dell’energia libera.
; in particolar modo P è alta quando la derivata seconda dell’energia libera è negativa; in questo caso la separazione avviene spontaneamente. Dalla figura 12 § 4.8 vediamo che la derivata seconda dell’energia libera diventa negativa all’interno dei due punti di flesso A e B il sistema diviene instabile per infinitesime fluttuazioni di composizione e si avrà quindi separazione di due fasi con un abbassamento dell’energia libera.
Figura 12 § 4.8
All’esterno dei punti di flesso la derivata seconda diviene sempre più positiva facendo diventare il termine di probabilità sempre più piccolo. Per chiarire meglio consideriamo un altro diagramma (figura 13) § 4.9: in questo caso si ha un sistema tenuto ad una temperatura T inferiore a quella del consoluto Tc: se la sua composizione XB è tra i due punti di flesso (fig.13a) in un primo stadio del processo di smiscelazione si separeranno due fasi liquide (a) e (b) con un energia libera media G2, ottenuta congiungendo i due punti, più bassa di G1 (valore iniziale del liquido).Col progredire del processo le due fasi continueranno a spostarsi in composizione fino ad arrivare all’equilibrio nelle composizioni xI ed xII mentre l’energia libera media scenderà fino al valore G3, questo è il caso di una decomposizione spinodale.
Figura 13 § 4.9
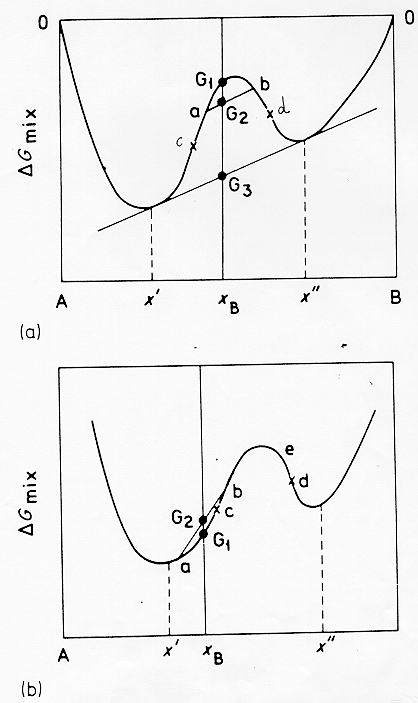
Se invece (fig.13b) XB si trova al di fuori dei punti di flesso una piccola variazione composizionale .che portasse ad esempio alle fasi(a) e (b) causerebbe sempre un aumento dell’energia libera (in questo caso da G1 a G2 ).
Qui siamo quindi in presenza di una barriera alla nucleazione se ci sarà separazione di fasi questa sarà originata da un processo attivato di nucleazione e successivo accrescimento,in questo caso avremo una dispersione di gocce di liquido piuttosto che due fasi interconnesse come nella separazione spinodale.
1.6) Modello di Hildebrandt
Figura 14 § 4.10
Il fenomeno della immiscibilità liquido-liquido è stato descritto quantitativamente da Hildebrandt per un sistema binario come vediamo in figura 14§ 4.10, nel quale gli atomi delle specie A e B sono casualmente disposti in una struttura regolare, l’energia libera di mescolamento è data dall’equazione:
![]()
![]()
dove X è la frazione molare del componente B ed a è definita da una espressione che contiene il numero di Avogadro N, il numero di coordinazione Z e le energie di legame interatomiche EAB, EAA, EAB. Si può inoltre facilmente dimostrare che a è legata alla temperatura della consoluta dalla relazione:
![]()
Perché ci sia immiscibilità a deve essere positiva. Secondo questo modello le curve dell’energia libera di miscelazione così come le curve spinodali e binodali sono simmetriche con un massimo per x = 0,5.
Questo modello non descrive il comportamento reale dei vetri silicatici che hanno una struttura più complessa di una semplice miscela random di atomi, come si osserva in sistemi binari SiO2-M2O le campane di immiscibilità hanno un massimo per una composizione critica pari a X = 0,1.
La causa di questa discrepanza è data principalmente dal fatto che i due ossidi non subiscono in fase liquida una perfetta miscelazione e dal fatto di aver considerato nel modello gli atomi come sfere perfette.
1.7) Modello di Haller
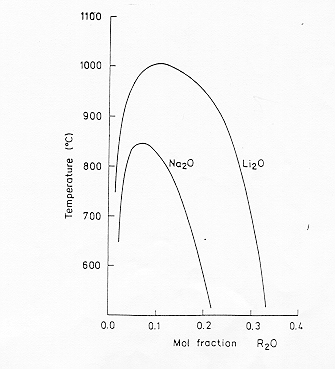
E’ stato proposto un modello in cui il liquido è costituito da una miscela di molecole complesse "multimeri" (SiO2)n e di un composto stechiometrico del tipo ![]() , scegliendo appropriati valori di m ed n si riesce ad avere un buon fitting con le curve osservate (tabella 1).
, scegliendo appropriati valori di m ed n si riesce ad avere un buon fitting con le curve osservate (tabella 1).
Tabella 1
|
m |
n |
sistema |
|
6 |
2 |
Li2O-SiO2 |
|
8 |
3 |
Na2O-SiO2 |
|
8 |
2 |
Na2O-SiO2 |
1.8) Evidenze sperimentali
Come vediamo in figura 15 § 4.12 nel caso di un sistema BaO-SiO2-B2O3 si osserva una separazione multifase; se osserviamo il processo "step by step" possiamo notare come all’interno di ciascuna fase è possibile la separazione di ulteriori fasi, nel caso specifico se ne contano ben otto, in effetti una separazione multifase è la conseguenza di un incompleto o impedito processo di diffusione durante il raffreddamento. Questo fatto è messo sperimentalmente in evidenza dalla presenza di gusci intorno alle gocce, in figura 16 § 4.13 è mostrato un vetro boro-silicatico al bario nel quale si è separata una fase ricca in borato di bario con intorno un guscio di composizione SiO2, in questo caso la fase SiO2 é stata eliminata mediante etching con HF diluito.
Figura 15 § 4.12
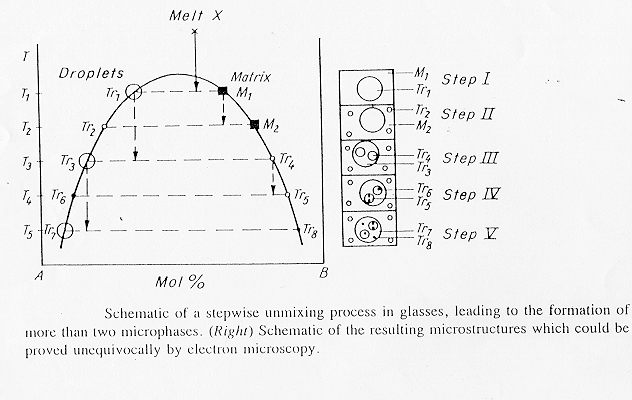
Figura 16 § 4.13

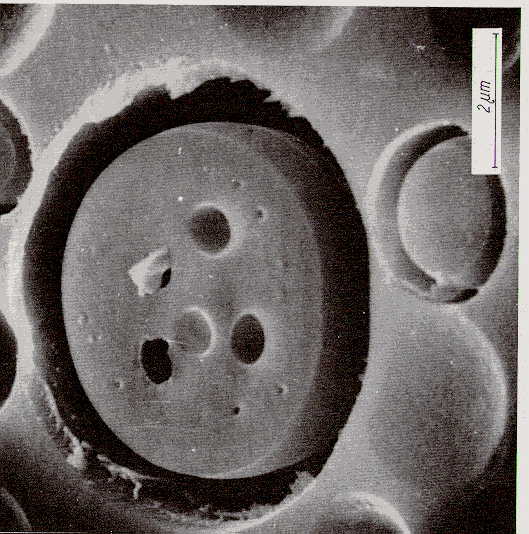
1.9) Immiscibilità, considerazioni finali
1) Sistemi monocomponenti di ossidi vetro-formatori in genere solidificano in un vetro omogeneo
2) Vetri i cui fusi corrispondono ad un definito composto chimico stabile solidificano in un vetro omogeneo
3) Vetri di composizione intermedia tra due composti stabili tendono alla smiscelazione
4) In una smiscelazione di due o più fasi liquide la composizione chimica delle fasi tende ad avvicinarsi a quella di composti stechiometrici ovviamente questa tendenza è condizionata dal gradiente di raffreddamento del fuso e quindi dalla diffusione ionica.
5) Elementi appartenenti alle serie di transizione si concentrano nelle microfasi che offrono la migliore coordinazione possibile, cioè in quelle fasi più ricche di anioni (ossigeni non a ponte). Nell’esempio fatto elementi cromogeni come Ni++ o Co++ si concentrano nella fase ricca di borato di bario lasciando libera la fase ricca di silice.
1.10) Controllo della separazione di fase
Per formare vetri omogenei si deve quindi scegliere una composizione vicina a quella di un composto stechiometrico. Si può agire sulla forza di campo degli ossidi modificatori: nel sistema M2O-SiO2 procedendo nella serie ![]() la forza di campo aumenta facendo diminuire la tendenza alla separazione di fase.
la forza di campo aumenta facendo diminuire la tendenza alla separazione di fase.
L’aggiunta di additivi che modificano la struttura dei vetri possono indurre separazione liquido-liquido: un aumento nella differenza di tensione superficiale favorisce il processo di smiscelazione così come la formazione di fasi con densità diverse. ioni fluoruro sostituendosi agli ossigeni provocano un aumento della fluidità (l’inverso della viscosità), la mobilità ionica quindi aumenta aumentando la probabilità di avere una smiscelazione
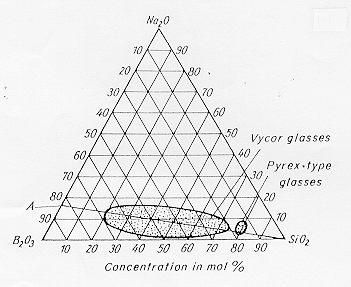
1.11) Processo Vycor
E’ una applicazione della immiscibilità di fasi vetrose nel sistema SiO2-B2O3-Na2O. Una composizione in ossidi del tipo: 72% SiO2 20% B2O3 8% Na2O (vedi diagramma in figura 17 § 4.14) viene fusa alla temperatura di circa 1000-1100°C quindi il fuso viene raffreddato in stampi e raffreddato.
Figura 17 § 4.14
Il manufatto così formato (crogioli, beute,cilindri...) viene riscaldato alla temperatura di 500-600°C al di sotto cioè della temperatura di consoluto Tc, in questo modo si ha una decomposizione spinodale con formazione di una fase interconnessa ricca in B2O3 e NaO2 e di un fase ricca in SiO2. Il vetro opalescente così ottenuto, dopo essere stato raffreddato viene trattato con una soluzione di un acido forte ( generalmente H2SO4 3N) a 90°C in questo modo la fase interconnessa borico-sodica viene lentamente distrutta, la velocità di estrazione è tipicamente compresa tra 0,8 e 1,5 mm h-1. Il pezzo viene quindi lavato ottenendo un vetro opaco poroso (le dimensioni dei pori sono uguali al diametro dei canali della fase disciolta, circa 20-50 Å ) che può essere reso trasparente con un processo di sinterizzazione a 1200 °C.
L’analisi chimica media del prodotto finale é SiO2: 98%, B2O3: 1,5%, Na2O:0,5%.
Figura 18

Nella immagine a destra di figura 18 è riportata una composizione appartenente all’estremità destra della immiscibilità nel diagramma di figura 17 1818§ 4.14 (processo Vycor) mentre nell’immagine di sinistra si vede l’immagine relativa ad una composizione situata alla estremità opposta, in questo caso non si ha decomposizione spinodale ma una nucleazione ed accrescimento di una fase liquida in un’altra che quindi assume la forma di gocce immerse in una matrice.